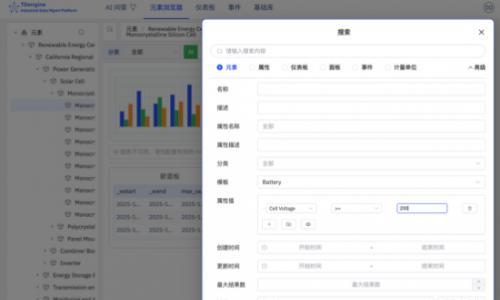
美国食品药品监督管理局(FDA)计划改革罕见病基因编辑疗法的审批路径,推动个性化治疗迈向规模化应用。新规将允许采用“平台化”模式,在统一的“主方案”下开展伞式临床试验,合并评估针对多种遗传病的相似疗法。这一调整源于CRISPR技术的发展与全球首例个性化体内基因编辑治疗成功案例的启示。费城儿童医院团队通过脂质纳米颗粒递送系统,仅定制引导RNA即可靶向不同致病基因,显著提升研发效率。FDA已同意后续疗法无需重复动物实验,并可共享早期临床数据,大幅缩短审批周期。该模式有望为极少数患者群体提供可持续的精准治疗方案。
免责声明:本文内容由开放的智能模型自动生成,仅供参考。








 扫一扫关注微信
扫一扫关注微信